W przebiegu cukrzycy możemy mieć do czynienia z szeregiem powikłań ogólnoustrojowych, w tym także ze strony narządu wzroku. Najczęściej mówi się o retinopatii cukrzycowej, gdyż stanowi potencjalną przyczynę utraty widzenia.
Równie często u pacjentów z cukrzycą spotyka się choroby powierzchni oka, które także mogą stanowić przyczynę pogorszenia widzenia. Najczęściej są diagnozowane zespół suchego oka i keratopatia związana z obniżonym czuciem rogówki w przebiegu neuropatii cukrzycowej. Istotna jest odpowiednio wczesna diagnostyka i prawidłowe leczenie.
Cukrzyca stanowi istotny problem zdrowotny, który doprowadza do poważnych powikłań związanych z mikroangiopatią, takich jak: neuropatia, nefropatia, retinopatia oraz makroangiopatią, jak zawał serca. Cukrzyca należy do chorób cywilizacyjnych. Częstość jej występowania rośnie w szybkim tempie, zbliżając się do poziomu epidemii. Według raportu WHO w 2014 roku dotknięte cukrzycą było 442 miliony ludzi na świecie i liczba ta uległa podwojeniu od 1980 roku. W Polsce na cukrzycę choruje około 9,5 proc. populacji[1].
Wyróżniamy cukrzycę typu 1 ? insulinozależną, na którą zaczynają chorować osoby przed 30. rokiem życia, spowodowaną niedostateczną produkcją insuliny z powodu utraty komórek beta trzustki, cukrzycę typu 2 ? typową cukrzycę osób starszych, związaną z insulinoopornością tkanek oraz cukrzycę ciężarnych, która jest stanem przejściowej insulinooporności, ale stanowi istotny czynnik ryzyka cukrzycy typu 2. Narząd wzroku to jeden z narządów dotkniętych powikłaniami cukrzycy. Najczęściej spotykamy się z retinopatią cukrzycową, która może prowadzić do utraty widzenia. Spośród innych powikłań stwierdzamy choroby powierzchni oka, w tym zespół suchego oka, który dotyka około 54 proc. pacjentów z cukrzycą[2].
Choroby powierzchni oka w cukrzycy
Cukrzyca stanowi jeden z czynników ryzyka wystąpienia zespołu suchego oka (ZSO). Udokumentowana częstość występowania ZSO została oszacowana na 14-33 proc. u pacjentów z cukrzycą powyżej 65. roku życia i rośnie wraz z wiekiem[3]. Zespół suchego oka zgodnie z definicją II Raportu ds. Zespołu Suchego Oka (Dry Eye Workshop Study DEWS II) to: ?wieloczynnikowa choroba dotycząca powierzchni oka, która charakteryzuje się utratą homeostazy filmu łzowego, a w towarzyszących jej objawach, główną rolę odgrywają niestabilność filmu łzowego, hiperosmolarność, zapalenie i uszkodzenie powierzchni oka oraz zaburzenia neurosensoryczne?[4]. Z praktycznego punktu widzenia ZSO dzieli się na dwie postaci: ZSO z niedoborem łez (Aqueous Deficient Dry Eye ADDE) oraz postać z nadmiernym parowaniem (Evaporative Dry Eye EDE).
W mechanizmie zespołu suchego oka podstawową rolę odgrywają hiperosmolarność i zapalenie[5]. Sygnał związany z hiperglikemią wpływa poprzez połączenia neuronalne na układ wzrokowy, czyli tak zwaną łzową jednostkę funkcjonalną, w skład której wchodzą rogówka, spojówka, główne gruczoły łzowe i gruczoły dodatkowe, gruczoły Meiboma, powieki oraz czuciowy i ruchowy układ nerwowy. Dochodzi do zmniejszonej produkcji łez lub nadmiernej ich utraty, zaburzeń w mruganiu oraz zmian w składzie łez. Te procesy doprowadzają do zespołu suchego oka[6].
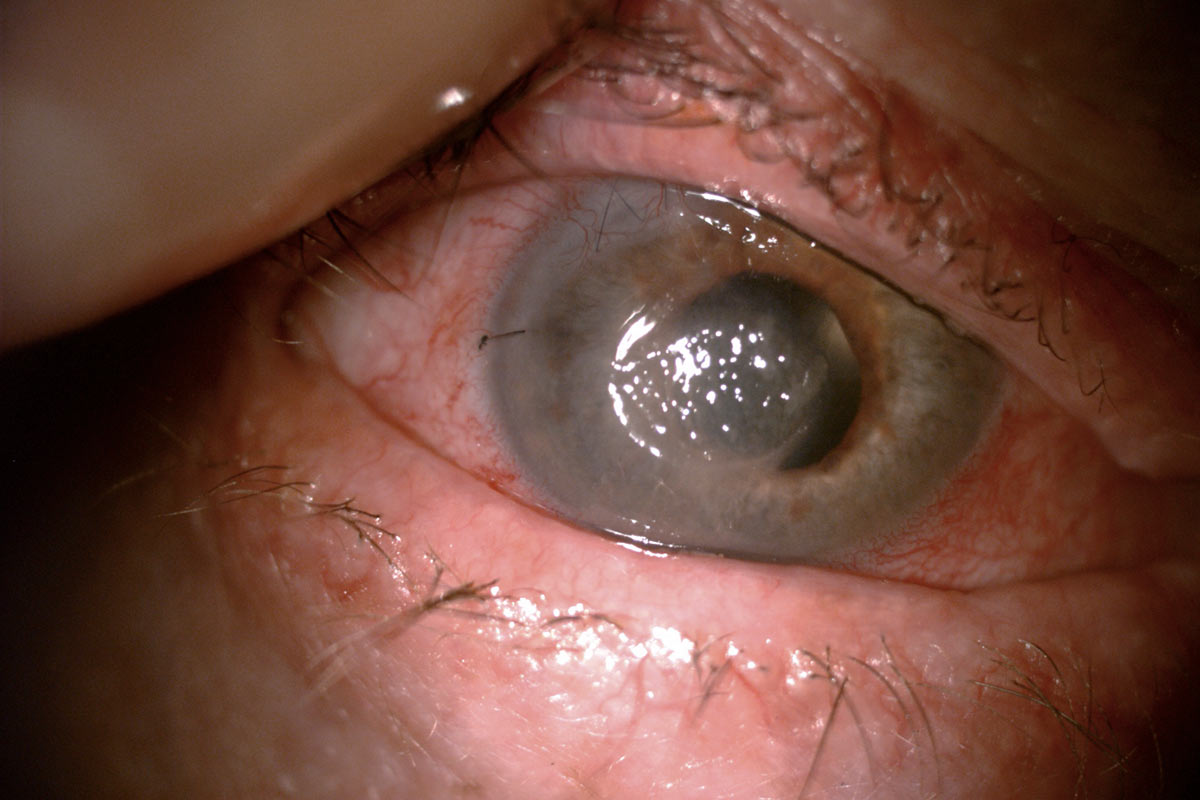
W obrębie chorób powierzchni oka związanych z cukrzycą możemy się spotkać z zaburzeniami nabłonka rogówki, bowiem cukrzyca powoduje zaburzenie bariery nabłonkowej. Pacjenci z cukrzycą z podwyższonym poziomem HbA1c (hemoglobina glikozylowana) są bardziej narażeni na upośledzenie funkcjonowania bariery nabłonkowej, a więc i powikłań rogówkowych[7]. Do tych powikłań związanych z podwyższonym poziomem glikemii należą powierzchowna punktowa keratopatia, owrzodzenia troficzne, przetrwałe ubytki nabłonka rogówki oraz nawracające erozje[8].
Pacjenci z cukrzycą zdecydowanie częściej niż zdrowa populacja mają erozje nabłonka rogówki, które mogą nawracać i być oporne na konwencjonalne leczenie. Schorzenie to określa się jako cukrzycową keratopatię. Stwierdza się ją zdecydowanie częściej u pacjentów z retinopatią cukrzycową[9,10,11]. Uważa się, że ma to związek z akumulacją końcowych produktów glikacji białek (AGE) w błonie podstawnej nabłonka rogówki. Doprowadza to bowiem do nieprawidłowo słabych połączeń pomiędzy komórkami warstwy podstawnej nabłonka rogówki a błoną podstawną[12]. Również utrata czucia rogówki uważana jest za czynnik ryzyka cukrzycowej keratopatii[13]. Degeneracja aksonów niezmielinizowanych nerwów rogówkowych zachodzi pod wpływem przewlekłej hiperglikemii.
U pacjentów z cukrzycą poddanych zabiegowi witrektomii należy zwrócić szczególną uwagę na niegojące się erozje nabłonka rogówki. Jeśli nabłonek zostanie usunięty manualnie, aby chirurg miał lepszy obraz, ten stan może pogorszyć się i doprowadzić do poważnych powikłań[11,14].
Patogeneza chorób powierzchni oka związanych z cukrzycą
Cukrzyca może wywoływać ZSO poprzez szereg różnych mechanizmów. Przewlekła hiperglikemia, obwodowa cukrzycowa neuropatia, zmniejszony poziom insuliny, mikroangiopatia to czynniki ryzyka ZSO w przebiegu cukrzycy. Insulina jest niezbędna do proliferacji gronek gruczołu łzowego oraz komórek nabłonka rogówki[15]. U pacjentów z cukrzycą stwierdzono podwyższony poziom glukozy we łzach, jak również końcowych produktów glikacji białek (AGE ? advanced glycation end-product), które mogą służyć za markery cukrzycy[16]. Podwyższony poziom glukozy stanowi czynnik wyzwalający zapalenie, które wywołuje szereg reakcji adaptacyjnych układu immunologicznego narządu wzroku. Ponadto w wyniku hiperglikemii rośnie hiperosmolarność na powierzchni oka i stymuluje to kaskadę reakcji zapalnych, w wyniku, której aktywacji ulega między innymi szlak kinaz MAP[6,17].
Inny mechanizm związany z ZSO w przebiegu cukrzycy to neuropatia rogówki, która prowadzi do niestabilności filmu łzowego oraz obniżonej wartości czasu przerwania filmu łzowego (TBUT) z powodu utraty komórek kubkowych spojówki, które produkują mucynę pokrywającą powierzchnię komórek nabłonka rogówki i ograniczającą odparowanie łez[18].
Cukrzycowa neuropatia stanowi ponadto istotny czynnik ryzyka dysfunkcji gruczołu łzowego. Może mieć to związek z nieprawidłową kontrolą gruczołu łzowego przez układ autonomiczny, którego funkcja zostaje upośledzona przez cukrzycową neuropatię[19]. Ponadto obniżenie czucia rogówki doprowadza do zmniejszenia podstawowego wydzielania łez[20].
Czuciowe unerwienie rogówki jest najistotniejszym czynnikiem prawidłowego funkcjonowania i gojenia się nabłonka rogówki[21]. Unerwienie rogówki pochodzi od nerwu trójdzielnego i umożliwia przetwarzanie sygnałów termicznych, mechanicznych i chemicznych na uczucie suchości, dyskomfortu i bólu[22]. W odpowiedzi na zewnętrzne czynniki drażniące, takie jak kurz czy patogeny, nerwy rogówkowe stymulują produkcję łez i odruch mrugania[23]. Rogówka stanowi najbardziej unerwioną część ludzkiego ciała, a nerwy rogówkowe pełnią istotną neurotroficzną rolę w prawidłowej strukturze powierzchni rogówki. Odbywa się to poprzez wydzielanie mediatorów, które stymulują wzrost komórek nabłonka, ich mitozę, różnicowanie i przemieszczanie oraz procesy gojenia. Również komórki nabłonka rogówki, wydzielając czynniki wzrostu, wspomagają odżywienie nerwów[24]. W cukrzycy dochodzi do redukcji tych mediatorów, prowadząc do utraty integralności nabłonka, a to z kolei zwiększa ubytek neuronów i doprowadza do osłabienia nabłonka i jego ścieńczenia[25]. Utrata tej neurotroficznej funkcji może doprowadzić do niegojących się bądź przetrwałych ubytków nabłonka rogówki lub owrzodzeń neurotroficznych[26]. W cukrzycy dochodzi do zmniejszenia gęstości unerwienia rogówki oraz innych nieprawidłowości nerwów[27,28,29]. Zaburzenia unerwienia zachodzą w mechanizmie niedokrwienia z powodu mikroangiopatii związanej z cukrzycą oraz w wyniku akumulacji końcowych produktów glikacji białek, które inicjują uszkodzenie perycytów i śródbłonka naczyń, a więc zaburzają unaczynienie komórek Schwanna lub neuronów. Ten proces wpływa na ograniczenie funkcji nerwów[30].
Dzięki zastosowaniu mikroskopii konfokalnej możemy zobrazować nerwy rogówkowe. Ocenia się wówczas: gęstość połączeń nerwowych, gęstość gałęzi nerwów, długość i szerokość nerwów oraz ich przebieg[31]. W badaniach zaobserwowano, że w cukrzycy dochodzi do zmniejszenia długości nerwów, gęstości włókien nerwowych oraz rozgałęzień nerwów[32,33]. Ustalono, że zmniejszenie długości nerwów rogówkowych jest czynnikiem prognostycznym obwodowej neuropatii[34].
Uszkodzenie nerwów rogówkowych doprowadza do neurotroficznej keratopatii bezpośrednio poprzez utratę odżywienia i pośrednio poprzez suche oko w wyniku zmniejszonej produkcji łez i mucyn[35].
Objawy
Pacjenci z cukrzycą i zespołem suchego oka prezentują podobne objawy jak pacjenci bez cukrzycy. Będą się skarżyć na: pieczenie, kłucie, uczucie ciała obcego, zaburzenia widzenia. W badaniach diagnostycznych stwierdza się nieprawidłowości czasu przerwania filmu łzowego (TBUT), obniżony wynik testu Schirmera oraz barwienie fluoresceiną[2]. Pacjenci z długo trwającą cukrzycą mogą zgłaszać mniej objawów, co może mieć związek z obniżonym czuciem rogówki spowodowanym przez obwodową neuropatię cukrzycową[36].
Leczenie
Wczesne wykrycie zespołu suchego oka u pacjentów z cukrzycą jest bardzo istotne, ponieważ może uchronić ich od powikłań w postaci pogorszenia widzenia, bliznowacenia rogówki, owrzodzeń, wtórnych zapaleń bakteryjnych. Schemat leczenia ZSO jest taki sam dla pacjentów z cukrzycą i bez cukrzycy z tym, że pacjenci z cukrzycą wymagają większej uwagi, gdyż w większym stopniu narażeni są na powikłania ZSO. Zaleca się stosowanie preparatów sztucznych łez, kropli o działaniu przeciwzapalnym, a w zaawansowanych przypadkach kropli z surowicy własnej, które stanowią dobre źródło witamin, immunoglobulin i czynników wzrostu. Spośród kropli o działaniu przeciwzapalnym najczęściej stosuje się kortykosteroidy, gdyż zmniejszają objawy i zapobiegają defektom nabłonka rogówki[37]. Nie można jednak zapomnieć o działaniach niepożądanych tych leków, takich jak bakteryjne czy grzybicze zapalenia rogówki, wzrost ciśnienia wewnątrzgałkowego, zwiększone ryzyko rozwoju zaćmy[38]. Aby uniknąć powikłań kortykosteroidów można zastosować preparaty z cyklosporyną, która zwiększa produkcję łez oraz zmniejsza utratę komórek kubkowych spowodowaną przez zapalenie[39].
Z nowych terapii miejscowych próbuje się stosować karnozynę, która jest antyoksydantem, naltrekson, miejscowe czynniki wzrostu oraz eksperymentalne terapie genowe. Naltrekson to agonista opioidowy, który wykazuje działanie przyspieszające gojenie ran rogówki oraz odbudowę czucia rogówki. Spośród czynników wzrostu zastosowanie mają przede wszystkim insulinopodobny czynnik wzrostu i czynnik wzrostu nerwów, gdyż zwiększają proliferację komórek i poprawiają gęstość nerwów rogówkowych[40]. Zwrócono również uwagę na korzystne działanie antyoksydacyjne kwasu alfa-liponowego. W badaniach potwierdzono zwiększoną produkcję łez i poprawę w teście Schirmera.[41]
Podsumowanie
Cukrzyca i jej powikłania stanowią istotny czynnik ryzyka ślepoty. Wszystkim okulistycznym schorzeniom związanym z cukrzycą można zapobiegać poprzez odpowiednio wczesną diagnozę i leczenie. Ważna jest edukacja pacjentów, aby regularnie zgłaszali się do okulisty. W prewencji i procesie leczenia istotna jest skuteczna kontrola choroby ? utrzymywanie poziomu glukozy na odpowiednim poziomie.
tekst: Lek. Anna Bielecka 2 | Prof. dr hab. n. med. Jacek P. Szaflik 1,2 | 1. Katedra i Klinika Okulistyki II Wydziału Lekarskiego WarszawskiEGO UniwersytetU MedycznEGo | 2. Samodzielny Publiczny Kliniczny Szpital Okulistyczny w Warszawie
Piśmiennictwo:
1. Global report on diabetes. World Health Organization. ISBN 978 92 4 156525 7 (NLM classification: WK 810) WHO 2016.
2. Manaviat M.R., Rashidi M., Afkhami-Ardekani M., Shoja M.R., ?Prevalence of dry eye syndrome and diabetic retinopathy in type 2 diabetic patients?, BMC Ophthalmolog, 2008; 8 art. 10.
3. Dry Eye Syndrome, NICE CKS, Sep 2012.
4. TFOS DEWS II Report 2017. The Ocular Surface. 2017; 15: 269?649.
5. Bielecka A., Szaflik J.P. ?Zespół suchego oka: epidemiologia jego dwóch postaci ? wynikającej z nadmiernego parowania filmu łzowego oraz z niedoboru wodnej składowej filmu łzowego?; Okulistyka 4, 2017; 74-81.
6. Research in dry eye: report of the Research Subcommittee of the International Dry Eye Workshop 2007?, The Ocular Surface, 2007; 2: 179-193.
7. Gekka M., Miyata K., Nagai Y.et al., ?Corneal epitjelial barier function in diabetic patients?, Cornea, 2004; 1: 35-37.
8. ?Vaughan and Asbury?s general ophthalmology, 17th edition?, Clin and Exper Optometry, 2008; 6:577-577.
9. Friend J., Thoft R.A. ?The diabetic cornea?. Int Ophthalmol Clin. 1984;24:111?123.
10. Datiles M.B., Kador P.F., Fukui H.N., Hu T.S., Kinoshita J.H. ?Corneal re-epithelialization in galactosemic rats?. Invest Ophthalmol Vis Sci. 1983;24:563?569
11. Perry H.D., Foulks G.N., Thoft R.A., Tolentino F.I. ?Corneal complications after closed vitrectomy through the pars plana?. Arch Ophthalmol. 1978;96:1401?1403
12. Kaji Y., Usui T., Oshika T., Matsubara M., Yamashita H., Araie M., Murata T., Ishibashi T., Nagai R., Horiuchi .S, et al. ?Advanced glycation end products in diabetic corneas?. Invest Ophthalmol Vis Sci. 2000;41:362?368.
13. Saito J., Enoki M., Hara M., Morishige N., Chikama T., Nishida T. ?Correlation of corneal sensation, but not of basal or reflex tear secretion, with the stage of diabetic retinopathy?. Cornea. 2003;22:15?18.
14. Schultz R.O., Van Horn D.L., Peters M.A., Klewin K.M., Schutten W.H. ?Diabetic keratopathy?. Trans Am Ophthalmol Soc. 1981;79:180?199.
15. Dias A.C., Batista T.M., Roma L.P., et al. ?Insulin replacement restores the vesicular secretory apparatus in the diabetic rat lacrimal gland?. Arquivos Brasileiros de Oftalmologia. 2015;78(3):158?163.
16. Zhao Z., Liu J., Shi B., He S., Yao X., Willcox M.D.P. ?Advanced glycation end product (AGE) modified proteins in tears of diabetic patients?. Molecular Vision. 2010;16:1576?1584.
17. Luo L., Li D.-Q., Corrales R.M., Pflugfelder S.C. ?Hyperosmolar saline is a proinflammatory stress on the mouse ocular Surface?. Eye and Contact Lens. 2005;31(5):186?193, 11 Li D.-Q., Luo L., Chen Z., Kim H.-S., Song X. J., Pflugfelder S. C. JNK and ERK MAP kinases mediate induction of IL-1?, TNF-? and IL-8 following hyperosmolar stress in human limbal epithelial cells. Experimental Eye Research. 2006;82(4):588?596. doi: 10.1016/j.exer.2005.
18. Dogru M., Katakami C., Inoue M. ?Tear function and ocular surface changes in noninsulin-dependent diabetes mellitus?. Ophthalmology. 2001;108:586?592.
19. Nakata M., Okada Y., KobataH. et al., ?Diabetes mellitus suppressehemodialysis-induced increases in tear fluid secretion?, BMC Research Notes, 2014; 1, art. 78.
20. Cousen P., Cackett P., Bennett H., Swa K., Dhillon B. ?Tear production and corneal sensitivity in diabetes?. J Diabetes Complications. 2007;21:371?373.
21. Byun Y.S., Kang B., Yoo Y.S., Joo CK. ?Poly(ADP-Ribose) polymerase inhibition improves corneal epithelial innervation and wound healing in diabetic rats?. Invest Ophthalmol Vis Sci 2015; 56: 1948?1955.
22. Belmonte C. ?Eye dryness sensations after refractive surgery: impaired tear secretion or phantom cornea??. J Refract Surg. 2007;23:598?602.
23. Stern M.E., Gao J., Siemasko K.F. et al. ?The role of the lacri-mal functional unit in the pathophysiology of dry eye?. Exp Eye Res. 2004;78(3):409?16.
24. Muller L.J., Marfurt C.F., Kruse F. and Tervo T.M. ?Corneal nerves: structure, contents and function?. Exp Eye Res. 2003; 76: 521?542.
25. Cai D., Zhu M., Petroll W.M., Koppaka V. and Robertson D.M. ?The impact of type 1 diabetes mellitus on corneal epithelial nerve morphology and the corneal epithelium?. Am J Pathol. 2014; 184: 2662?2670.
26. Davidson E.P., Coppey L.J., Holmes A., Yorek M.A. ?Changes in corneal innervation and sensitivity and acetylcholine-mediated vascular relaxation of the posterior ciliary artery in a type 2 diabetic rat?. Invest Ophthalmol Vis Sci 2012; 53: 1182?1187.
27. Wang H., Fan D., Zhang S., Wang X. [Early diagnosis of painful diabetic neuropathy by corneal confocal microscopy]. Zhonghua yi xue za zhi 2014; 94: 2602?2606.
28. Messmer E.M., Schmid-Tannwald C., Zapp D., Kampik A. ?In vivo confocal microscopy of corneal small fiber damage in diabetes mellitus.? Graef Arch Clin Exp Ophthalmol=Albrecht von Graef Arch Klin Exp Ophthalmol 2010; 248: 1307?1312.
29. Nitoda E., Kallinikos P., Pallikaris A., Moschandrea J., Amoiridis G., Ganotakis E.S. et al. ?Correlation of diabetic retinopathy and corneal neuropathy using confocal microscopy?. Curr Eye Res 2012; 37: 898?906.
30. Bikbova G., Oshitari T., Tawada A., Yamamoto S. ?Corneal changes in diabetes mellitus?. Curr Diabetes Rev 2012; 8: 294?302.
31. Oliveira-Soto, L. and Efron, N. ?Morphology of corneal nerves using confocal microscopy?. Cornea. 2001; 20: 374?384.
32. Ziegler D., Papanas N., Zhivov A., Allgeier S., Winter K., Ziegler, I. et al. ?Early detection of nerve fiber loss by corneal confocal microscopy and skin biopsy in recently diagnosed type 2 diabetes?. Diabetes. 2014; 63: 2454?2463.
33. Petropoulos I.N., Alam U., Fadavi H., Asghar O., Green P., Ponirakis G. et al. ?Corneal nerve loss detected with corneal confocal microscopy is symmetrical and related to the severity of diabetic polyneuropathy. Diabetes Care. 2013; 36: 3646?3651.
34. Pritchard N., Edwards K., Dehghani C., Fadavi H., Jeziorska M., Marshall, A. et al. ?Longitudinal assessment of neuropathy in type 1 diabetes using novel ophthalmic markers (LANDMark): study design and baseline characteristics?. Diabetes Res Clin Pract. 2014; 104: 248?256.
35. Shaheen B.S., Bakir M. and Jain S. ?Corneal nerves in health and disease?. Surv Ophthalmol. 2014; 59: 263?285.
36. Fuerst N., Langelier N., Massaro-Giordano M., et al. ?Tear osmolarity and dry eye symptoms in diabetics?. Clinical Ophthalmology. 2014;8:507?515.
37. Yang C.-Q., Sun W., Gu Y.-S. ?A clinical study of the efficacy of topical corticosteroids on dry eye?. Journal of Zhejiang University SCIENCE B. 2006;7(8):675?678.
38. Sayin N., Kara N., Pekel G. ?Ocular complications of diabetes mellitus?. World Journal of Diabetes. 2015;6(1):92?108.
39. Reitamo S., Remitz A., Kyllönen H., Saarikko J. ?Topical noncorticosteroid immunomodulation in the treatment of atopic dermatitis?. American Journal of Clinical Dermatology. 2002;3(6):381?388.
40. Shih K. Co., Lam K.S.-L., Tong L., ?A systemic review on the impact of diabetes mellitus on the ocular Surface?. Nutrition and diabetes 2017;7 : 1-10.
41. Andrade A., Salomon T.B., Behling C.S., Mahl C.D., Hackenhaar F.S., Benfato M.S. ?Alpha-lipoic acid restores tear production in an animal model of dry eye?. Exp Eye Res, 2014 Mar;120:1-9.